PARTIE CHIMIE ASPIRINE :
Propriétés physiques: L'aspirine fusionne à 130°c, elle est très soluble dans l'eau chaude (10g/L à 37°c), un peu moins dans l'eau froide (2.5g/L) à 15°c. Elle est aussi extrêmement soluble dans l'éthanol: 200g/L. Sa masse volumique est 1,4 g·cm-3.
Propriétés physiques: L'aspirine fusionne à 130°c, elle est très soluble dans l'eau chaude (10g/L à 37°c), un peu moins dans l'eau froide (2.5g/L) à 15°c. Elle est aussi extrêmement soluble dans l'éthanol: 200g/L. Sa masse volumique est 1,4 g·cm-3.
Pour comprendre le fonctionnement de cette synthèse qui fut initialement décrite par Gerhardt en 1853, il faut savoir que l’acide salicylique indispensable pour la
production d’aspirine est un acide carboxylique, c'est-à-dire qu’il est constitué de molécules dans laquelle un atome de Carbone est lié a un atome d’Oxygène par une double liaison, a un radical et à un groupement OH.
production d’aspirine est un acide carboxylique, c'est-à-dire qu’il est constitué de molécules dans laquelle un atome de Carbone est lié a un atome d’Oxygène par une double liaison, a un radical et à un groupement OH.
Formule semi- développée d’un acide carboxylique :
R=Radical, C=Atome de Carbone,
O= Atome d’oxygène, H= Atome d’hydrogène.
Il existe des acides carboxylique particuliers, parmi eux on distingue les ester, ses molécules ont la même constitution que celle des acides carboxylique à la différence que ce n’est plus un atomes d’hydrogène qui est lié a l’atome d’oxygène mais un atome de carbone lie a un atome de d'oxygène.
Formule semi-développée d’un ester :
O= Atome d’oxygène, R'= Second radical
Or, l’aspirine est un ester, il est donc synthétisé par estérification. En effet il résulte de la réaction entre l’anhydride d’un acide (l’anhydride acétique) et un
acide carboxylique (l'acide salycilique).
Estérification de l’acide acétylsalicylique :
Dans le cas précis de l’aspirine on peut parler aussi d’acétylation de l’acide salicylique, car le groupement hydroxyle -OH va être remplacé par le groupe acétoxy -O-CO-CH3. C’est a cette modification qu’est du la fonction ester de l’acide acétylsalicylique.
Formule semi-développée de l’acide salicylique :
Radical
Groupement acide carboxylique
Groupe hydroxyle
Groupe hydroxyle
Formule semi-développée de l’aspirine :
Radical
Groupement acide carboxylique
Deuxième radical (groupe acétoxy)
On distingue deux méthodes pour synthétiser l’acide acétylsalicylique :
Groupement acide carboxylique
Deuxième radical (groupe acétoxy)
On distingue deux méthodes pour synthétiser l’acide acétylsalicylique :
D’abord la méthode industrielle :
Pour la synthèse de l’aspirine dans l’industrie on utilise avant tout une molécule de phénol ou acide carbonique de formule C6H6O. Celle ci va réagir avec l’hydroxyde de sodium (NaOH) pour former ensemble une molécule de phénolate de sodium avant d’être réduite en poudre fine et traité avec du CO2 sous pression et a température élevée ce qui permet l’apparition du salicylate de sodium. Enfin ce dernier vas être transformé en acide salicylique en réagissant avec de l’acide sulfurique H2SO4. On appel cette synthèse la réaction de Kolbe.
-
-C6H6O + NaOH---->C6H5ONa + H2O (phénolate de sodium).
-C6H6O + NaOH---->C6H5ONa + H2O (phénolate de sodium).
-
-C6H5ONa + CO2 ----> C7H5NaO3 (salicylate de sodium).
-C6H5ONa + CO2 ----> C7H5NaO3 (salicylate de sodium).
-
-H2SO4+ C7H5NaO3 ----> C7H6O3+ (HSO4-) + (Na+) (acide salycilique, ion
hydrogeno-sulfat et ion sodium).
-H2SO4+ C7H5NaO3 ----> C7H6O3+ (HSO4-) + (Na+) (acide salycilique, ion
hydrogeno-sulfat et ion sodium).
Afin d’obtenir de l’acide acétylsalycilique il faut ensuite chauffé notre solution obtenue précédemment dans un chauffage a reflux avec de l’anhydride acétique, dans du méthylbenzène durant une vingtaine d’heure à 90°c, se forme alors de l’acide acétylsalicylique et de l’acide acétique7 en sous-produit. Ensuite
le mélange obtenu est refroidie jusqu'à 20°c dans un cristallisoire et les cristaux d’aspirines obtenus sont séparés de l’acide acétique par filtration.Puis les cristaux seront mis en pastille afin de pouvoir être commercialisé sous la forme de cachet.
C7H6O3+ C4H6O3 ----> C9H8O4 + C2H4O2 (acide acétylsalicylique et acide acétique).
Schéma simplifié d’un cycle de production d’aspirine :
1 | 2 | 3 | 4 | 5 | 6 |
Synthèse | Cristallisation | séparation solide / liquide | Séchage | Séparation gaz / solide | Mise en forme |
L'aspirine est aussi synthétisée avec une méthode de laboratoire...
1)- Préparation du mélange..
Préparer un bain marie a 60° C.
Introduire dans un ballon de 250 mL (bien sec)
- 5 g d’acide salicylique,
- 7 ml d’anhydride éthanoïque (ou acétique) :
- 3 gouttes d’acide sulfurique concentrés
- un barreau aimanté.
Agiter le mélange pendant environ 10 minutes.
Puis, on retire l'erlenmeyer du bain-marie et on verse immédiatement, mais progressivement 60 mL d’eau glacée dans la solution.
On place ensuite l’erlenmeyer dans un bain d’eau glacée pendant 10min.
On filtre alors le mélange obtenu sur verre fritté ou sur Büchner, en rinçant le précipité à l'eau distillée glacée, ensuite, on récupère les cristaux dans l’erlenmeyer.
2)- Purification:
Pour que le produit sois pur, il faut qu'il soit constitué que d'un seul type de molécule.
Nous allons donc le séparer des impuretés avec lesquelles il est mélangé.
Pour cela, nous allons utiliser la méthode chromatographique:
On verse dans trois petits bols A,B,et C de l'éthanol puis dissoudre:
- de l'acide salicylique dans le bol A
- de l'acide acétylsalicylique préparé dans le bol B
- et de l'aspirine du commerce broyée.
On place délicatement une goutte de chaque solution sur le papier chromatographique a la même hauteur pour comparer leurs vitesses. L'éluant utilisé contient 60% de cyclohexane, 20% d'acétate d'éthyle et 20% d'acide acétique.
Pour que le produit sois pur, il faut qu'il soit constitué que d'un seul type de molécule.
Nous allons donc le séparer des impuretés avec lesquelles il est mélangé.
Pour cela, nous allons utiliser la méthode chromatographique:
On verse dans trois petits bols A,B,et C de l'éthanol puis dissoudre:
- de l'acide salicylique dans le bol A
- de l'acide acétylsalicylique préparé dans le bol B
- et de l'aspirine du commerce broyée.
On place délicatement une goutte de chaque solution sur le papier chromatographique a la même hauteur pour comparer leurs vitesses. L'éluant utilisé contient 60% de cyclohexane, 20% d'acétate d'éthyle et 20% d'acide acétique.
3) Identification:
On observe le résultat après quelques minutes grâce à une lampe a UV. On entoure les 3 tâches.
La tâche de l’aspirine fabriquée et de l’aspirine du commerce sont au même niveau, de plus l’absence de tâches secondaires montre que le produit est pur.
PARTIE CHIMIE PARACETAMOL:
Propriété physique:Le paracétamol se dissout bien dans l'eau : 8 grammes par litre a 20 degrés Celsius et 250 grammes par litre a 100 degrés. Cependant, il est très peu soluble dans l'éther qui est un liquide incolore et très inflammable. L'éther est très souvent utilise comme solvant. Le paracétamol est également insoluble dans le chloroforme, qui est un compose chimique de formule CHCI3 aussi utilise comme solvant. Il fusionne entre 169 et 170°c, et sa masse volumique est à peu près 1.3 g·cm-3.
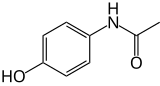
Le paracétamol, aussi appelé acétaminophène, qu'on trouve le plus souvent sous forme de poudre blanche, est le principe actif de nombreux médicaments. Sa formule brute est C8H9NO2. la molécule du paracétamol est constitue d'un cycle benzénique, c'est a dire de molécule de formule C6H6 sous la forme suivante :

Représentation d'un cycle benzénique:
Elle également constitue d'un groupe hydroxyle, c'est a dire par des liaison HO ainsi que par un groupement amide : un amide est un atome d'azote lié a un groupement carbonyle, le groupement carbonyle liant l'atome de carbone a un atome d'oxygène.
Représentation d'un amide:
Représentation du paracétamol:
Le paracétamol fut synthétisé pour la première fois par Harmon Northrop Morse en 1878. La première étape était de réduire le para-nitrophile C6H5NO3 en para-aminophenol C6H7NO.Pour effectuer cette réduction, il fallait faire une nitratation du phénol. La nitration est une réaction chimique qui permet d'ajouter un ou plusieurs groupement nitro NO2 dans une molécule.Cependant, depuis, on utilise le para-aminophenol comme produit de base pour faciliter l'expérience. Pour effectuer cette synthèse , il faut verser dans un ballon 3,10 grammes de para-aminophenol, 10 mL d’eau puis 4,0 mL d’anhydre ethanoique et chauffer le mélange pendant 30 minutes, puis le mettre à refroidir dans un bain d’eau froide. Un solide blanc apparait.

Une filtration au buchner est nécessaire pour isoler le solide obtenu du liquide.

Une filtration au buchner est nécessaire pour isoler le solide obtenu du liquide.
Ensuite, il faut recristalliser le solide : on obtient des cristaux de cristaux de paracétamol.
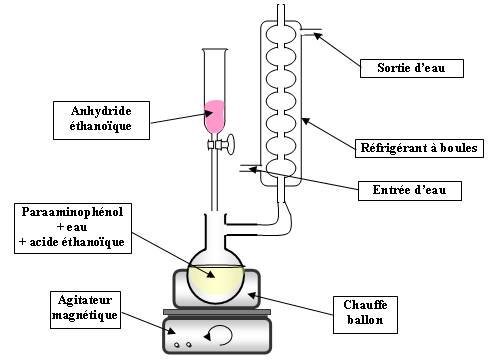
Schéma du montage de la synthèse du paracétamol:
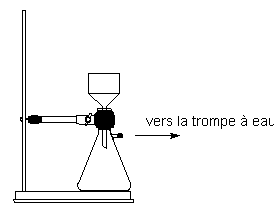
Buchner pour filtrer le solide obtenue:
Les molécules de para-aminophenol réagissent avec les molécules de d'anhydre éthanoïque pour former du paracétamol et de l'acide ethanoique, ce qui nous donne l'équation suivante :
C6H7NO + C4H6O3 ---> C6H9NO2 + C2H402.